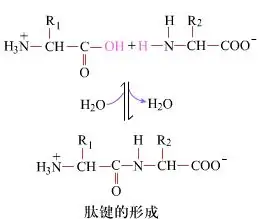
នៅលើផ្ទៃបង្កើតនៃចំណង peptides ទិន្នផល dipeptides គឺជាដំណើរការគីមីដ៏សាមញ្ញមួយ។នេះមានន័យថាសមាសធាតុអាស៊ីតអាមីណូទាំងពីរត្រូវបានភ្ជាប់ដោយចំណង peptide ដែលជាចំណងអាមីដ ខណៈពេលដែលត្រូវបានខ្សោះជាតិទឹក។
ការបង្កើតចំណង Peptide គឺជាការធ្វើឱ្យសកម្មនៃអាស៊ីតអាមីណូនៅក្រោមលក្ខខណ្ឌប្រតិកម្មស្រាល។(A) carboxyl moiety អាស៊ីតអាមីណូទីពីរ (B) nucleophilic activated carboxyl moiety បន្ទាប់មកបង្កើតជា dipeptide (AB) ។"ប្រសិនបើសមាសធាតុ carboxyl (A) មិនត្រូវបានការពារ ការបង្កើតចំណង peptide មិនអាចគ្រប់គ្រងបានទេ។"អនុផលដូចជា peptides លីនេអ៊ែរ និង cyclic អាចត្រូវបានលាយជាមួយសមាសធាតុគោលដៅ AB ។ដូច្នេះ ក្រុមមុខងារទាំងអស់ដែលមិនពាក់ព័ន្ធនឹងការបង្កើតចំណង peptide ត្រូវតែត្រូវបានការពារក្នុងលក្ខណៈដែលអាចបញ្ច្រាស់បានជាបណ្តោះអាសន្នក្នុងអំឡុងពេលសំយោគ peptide ។
ដូច្នេះ ការសំយោគ peptide - ការបង្កើតចំណង peptide នីមួយៗ - ពាក់ព័ន្ធនឹងការប្រមូលផ្តុំបីជំហាន។
ជំហានដំបូងគឺត្រូវរៀបចំអាស៊ីតអាមីណូមួយចំនួនដែលត្រូវការការការពារ ហើយរចនាសម្ព័ន្ធ zwitterionic នៃអាស៊ីតអាមីណូលែងមានទៀតហើយ។
ជំហានទីពីរគឺជាប្រតិកម្មពីរជំហានដើម្បីបង្កើតចំណង peptide ដែលក្នុងនោះក្រុម carboxyl នៃអាស៊ីតអាមីណូដែលការពារ N-protected ត្រូវបានធ្វើឱ្យសកម្មដំបូងទៅកម្រិតមធ្យមសកម្មហើយបន្ទាប់មកចំណង peptide ត្រូវបានបង្កើតឡើង។ប្រតិកម្មផ្សំគ្នានេះអាចកើតឡើងជាប្រតិកម្មមួយជំហាន ឬជាប្រតិកម្មបន្តបន្ទាប់គ្នាពីរ។
ជំហានទីបីគឺការដកយកចេញដោយជ្រើសរើសឬការដកយកចេញពេញលេញនៃមូលដ្ឋានការពារ។ទោះបីជាការដកយកចេញទាំងអស់អាចកើតឡើងបានតែបន្ទាប់ពីខ្សែសង្វាក់ peptide ទាំងអស់ត្រូវបានផ្គុំគ្នាក៏ដោយ ការដកយកចេញនូវក្រុមការពារត្រូវបានទាមទារផងដែរ ដើម្បីបន្តការសំយោគ peptide ។
ដោយសារតែអាស៊ីតអាមីណូចំនួន 10 (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec និង Cys) មានក្រុមមុខងារខ្សែសង្វាក់ចំហៀង ដែលទាមទារការការពារជ្រើសរើស ដែលធ្វើឱ្យការសំយោគ peptide កាន់តែស្មុគស្មាញ។មូលដ្ឋានការពារបណ្តោះអាសន្ន និងពាក់កណ្តាលអចិន្ត្រៃយ៍ត្រូវតែត្រូវបានសម្គាល់ដោយសារតែតម្រូវការផ្សេងគ្នាសម្រាប់ការជ្រើសរើស។ក្រុមការពារបណ្តោះអាសន្នត្រូវបានប្រើក្នុងជំហានបន្ទាប់ ដើម្បីឆ្លុះបញ្ចាំងពីការការពារបណ្តោះអាសន្ននៃអាស៊ីតអាមីណូ ឬក្រុមមុខងារ carboxyl ។ក្រុមការពារពាក់កណ្តាលអចិន្រ្តៃយ៍ត្រូវបានដកចេញដោយមិនជ្រៀតជ្រែកជាមួយចំណង peptide ដែលបានបង្កើតឡើងរួចហើយឬខ្សែសង្វាក់ចំហៀងអាស៊ីតអាមីណូ ជួនកាលក្នុងអំឡុងពេលសំយោគ។
"តាមឧត្ដមគតិ ការធ្វើឱ្យសកម្មនៃសមាសធាតុ carboxyl និងការបង្កើតចំណង peptide ជាបន្តបន្ទាប់ (ប្រតិកម្មភ្ជាប់) គួរតែលឿន ដោយមិនមានការរើសអើង ឬដោយផលិតផល ហើយប្រតិកម្ម molar គួរតែត្រូវបានអនុវត្តដើម្បីទទួលបានទិន្នផលខ្ពស់។"ជាអកុសល គ្មានវិធីសាស្រ្តភ្ជាប់គីមីណាមួយដែលបំពេញតម្រូវការទាំងនេះទេ ហើយមួយចំនួនតូចគឺសមរម្យសម្រាប់ការសំយោគជាក់ស្តែង។
កំឡុងពេលសំយោគ peptide ក្រុមមុខងារដែលពាក់ព័ន្ធនឹងប្រតិកម្មផ្សេងៗជាធម្មតាត្រូវបានភ្ជាប់ទៅនឹងមជ្ឈមណ្ឌលសៀវភៅដៃ គ្លីសេរីនជាករណីលើកលែងតែមួយគត់ ហើយមានហានិភ័យដែលអាចកើតមាននៃការបង្វិល។
ជំហានចុងក្រោយនៅក្នុងវដ្តនៃការសំយោគ peptide គឺការដកក្រុមការពារទាំងអស់។ការដកចេញនូវក្រុមការពារគឺមានសារៈសំខាន់សម្រាប់ផ្នែកបន្ថែមខ្សែសង្វាក់ peptide បន្ថែមពីលើតម្រូវការសម្រាប់ការដកការការពារពេញលេញក្នុងការសំយោគ dipeptide ។យុទ្ធសាស្រ្តសំយោគគួរតែត្រូវបានរៀបចំផែនការយ៉ាងប្រុងប្រយ័ត្ន។អាស្រ័យលើជម្រើសយុទ្ធសាស្ត្រ N អាចជ្រើសរើសក្រុមការពារα-amino ឬ carboxyl ចេញ។ពាក្យ "យុទ្ធសាស្ត្រ" សំដៅលើលំដាប់នៃប្រតិកម្ម condensation នៃអាស៊ីតអាមីណូនីមួយៗ។ជាទូទៅ មានភាពខុសគ្នារវាងការសំយោគបន្តិចម្តងៗ និងការ condensation បំណែក។ការសំយោគ Peptide (ត្រូវបានគេស្គាល់ផងដែរថាជា "ការសំយោគធម្មតា") កើតឡើងនៅក្នុងដំណោះស្រាយ។ក្នុងករណីភាគច្រើន ការពង្រីកបន្តិចម្តងៗនៃខ្សែសង្វាក់ peptide អាចត្រូវបានសំយោគដោយការប្រើខ្សែសង្វាក់ peptide ដើម្បីសំយោគបំណែកខ្លីៗ។ដើម្បីសំយោគ peptides យូរជាងនេះ ម៉ូលេគុលគោលដៅត្រូវតែត្រូវបានបែងចែកទៅជាបំណែកសមស្រប ហើយកំណត់ថាពួកគេអាចកាត់បន្ថយកម្រិតនៃភាពខុសគ្នានៅស្ថានីយ C ។បន្ទាប់ពីបំណែកនីមួយៗត្រូវបានប្រមូលផ្តុំជាបណ្តើរៗ បរិវេណគោលដៅនឹងត្រូវបានភ្ជាប់។យុទ្ធសាស្រ្តនៃការសំយោគ peptide រួមមានការជ្រើសរើសបំណែកការពារដ៏ល្អបំផុត និងសមស្របបំផុត ហើយយុទ្ធសាស្រ្តនៃការសំយោគ peptide រួមមានការជ្រើសរើសនៃការរួមបញ្ចូលគ្នាដ៏សមស្របបំផុតនៃមូលដ្ឋានការពារ និងវិធីសាស្រ្តដ៏ល្អបំផុតនៃការភ្ជាប់បំណែក។
ពេលវេលាផ្សាយ៖ ខែកក្កដា-១៩-២០២៣